Решение олимпиад по химии 11 класс
Решение олимпиад по химии 11 класс
- Под термином раствор обычно подразумевают жидкость, в которой равномерно распределено растворенное вещество. Такая система характеризуется определенным набором свойств. Истинные растворы имеют одинаковый состав в каждой точке объема.
Твердый раствор — система переменного состава, где атомы различных примесных элементов распределены в общей кристаллической решетке основного кристаллического вещества. Твердые растворы способны образовывать все кристаллические вещества. Атомы примеси могут располагаться в основной кристаллической решетке по-разному: упорядоченно и хаотически. Принято считать, что твердые растворы образуются лучше в том случае, если различие радиусов атомов основного и примесного вещества не превышает 15%.
Жидкие кристаллы образуют вещества, имеющие молекулы удлиненной формы. По степени упорядоченности жидкие кристаллы занимают промежуточное положение между жидкостями и твердыми кристаллами. Жидкие кристаллы характеризуются свойствами жидкости — текучестью и твердого кристалла — анизотропией, т.е. зависимостью физических свойств от направления. Другими словами, структура жидкого кристалла легко изменяется при некоторых внешних воздействиях (магнитное или электрическое поле) с изменением свойств.
Таким образом, кажущаяся парадоксальность этих терминов на самом деле оборачивается точным обозначением сути явления.
- По совокупности свойств, т.е. по поведению в реакциях с кислотами и гидроксидом натрия заключаем: I металл — серебро,(медь не подходит по цвету), металл II — алюминий, металл III — цинк.
Уравнения реакций:
2Al + 6HCl = 2AlCl3 + 3H2
Zn + 2HCl = ZnCl2 + 2H2
Ag + 2HNO3 (конц.) = AgNO3 + NO2 + H2O
Al + HNO3 (конц.) Нет реакции
Zn + 4HNO3 (конц.) + Zn(NO3)2 + 2NO2 + 2H2O
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2
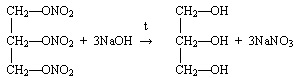
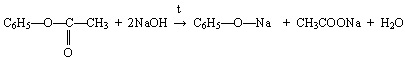
- Ответы могут быть различные.
- Cu + 2H2SO4 (конц.) → СuSO4 + SO2 + 2H2O
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4
Cu(OH)2 + глюкоза (альдегид) + NaOH → (нагревание)
→ Cu2O + H2O + глюконат натрия (натриевая соль карбоновой кислоты)
2Сu2O + O2 → 4CuO (прокаливание)
- Искомый углеводород не является метаном, т.к. плотность метана по водороду равна восьми.
Горение углеводорода СxНy описывается схемой реакции:
СxНy + (ч + 0,25у)О2 = хСО2 + 0,5уН2О … + О2 остаток
Количество вещества углекислого газа в х раз больше количества вещества исходного углеводорода. Количественные соотношения равны объемным, следовательно, объем углекислого газа в х раз больше объема исходного углеводорода.
Так как сумма объемов углекислого газа и остаточного кислорода составляет 120 мл, то 50х + V(О2)ост. = 120, откуда 50х < 120 и х < 2,4.
По условию х не равен единице (…искомый углеводород не является метаном), х < 2,4 и не может быть дробным числом, следовательно, х = 2.
Воспользуемся еще раз уравнением: 50х + V(О2)ост. = 120
Отсюда объем избыточного кислорода составляет V(О2)ост. = 120 – 50 x 2 = 20 мл.
|
|
 Олимпиадные задания по химии
Олимпиадные задания по химии Олимпиадные задания по химии
Олимпиадные задания по химии